


References by page
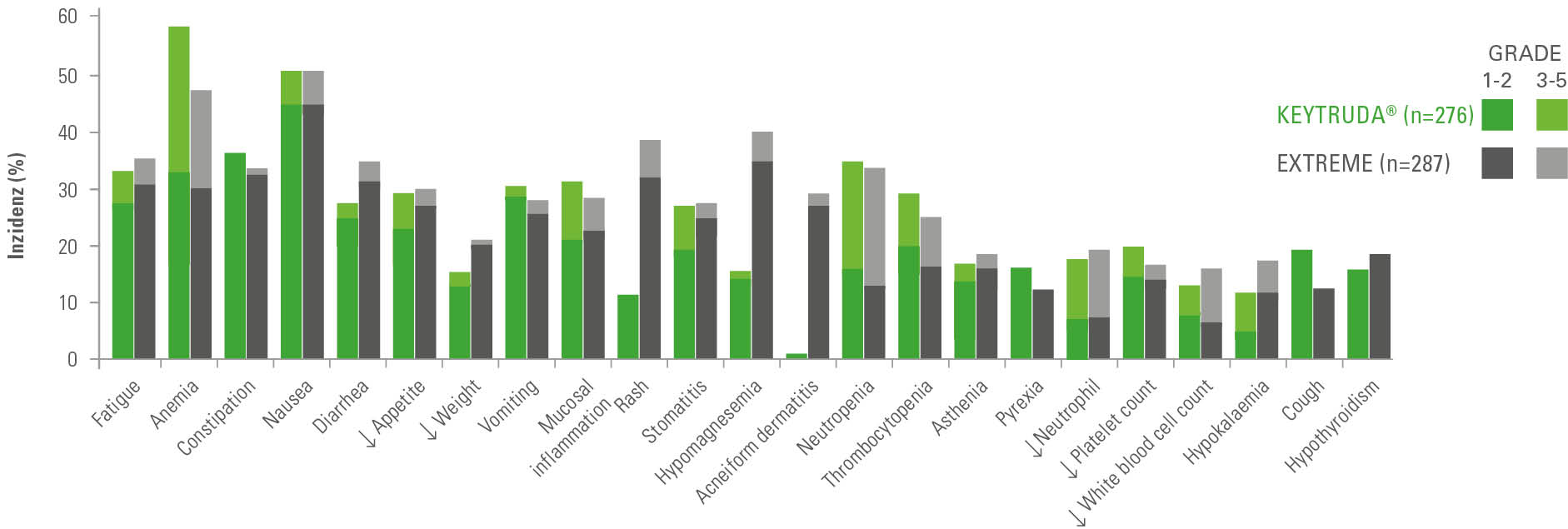
Sicherheitsprofil von KEYTRUDA ® + Plat/5-FU
vs. EXTREME (KEYNOTE-048) 1
Jegliche unerwünschte Ereignisse mit einer Inzidenz von ≥ 15
(All-Comers Population; Final Analysis) 2
Adaptiert nach Burtness et al. (suppl. Appx.)
Die Therapieabbruchrate aufgrund behandlungsassoziierter unerwünschter Ereignisse betrug
33% unter KEYTRUDA® + Plat/5-FU vs. 28% unter dem EXTREME-Regime. 2
Die Anzahl der unerwünschten Ereignisse, die zum Tod führten, betrug bei KEYTRUDA®
12% gegenüber 10% bei EXTREME. 2
Klicken Sie hier für
weitere Details zur Studie






References by page
TESTEN
IDENTIFIZIEREN
BEHANDELN
Testung der Patienten
auf PD-L1-Expression
Bestimmung der PD-L1
Expression, um
Behandlungsmöglichkeiten
zu erhalten
Behandlung geeigneter
Patienten mit Keytruda®,
gemäß der Zulassung
Testen sie ihre patienten bei der diagnostizierung eines fortgeschrittenen und metastasierten plattenepithelkarzinoms im kopf-hals-bereich auf eine PD-L1 expression 1
Wenn Sie Patienten mit einem fortgeschrittenen und metastasierenden Plattenepithelkarzinom im Kopf-Hals-Bereich behandeln:
Der CPS wird berechnet, indem die Zahl der PD-L1-positiven Tumorzellen und der Tumorassoziierten Immunzellen (einschließlich Lymphozyten und Makrophagen) durch die Gesamtzahl aller vitalen Tumorzellen in der Probe dividiert und mit 100 multipliziert wird. Der Score wird als Zahlenwert und nicht als Prozentwert angegeben, da das Ergebnis über 100 liegen kann. 4,5
KEYTRUDA® ist sowohl bei der Monotherapie, als auch bei der Kombinationstherapie mit Plat/5-FU, bei Patienten mit CPS ≥ 1 zugelassen. In der KEYNOTE-048 waren 85% der Patienten CPS ≥ 1 positive. 1
CPS = combined positive score
CPS =
x 100
Anzahl Zellen mit PD-L1 Anfärbung
Gesamtzahl vitaler Tumorzellen








References by page
* Abbildung nicht in Originalgröße.
Anwendung als
intravenöse Infusion
Dosierung von KEYTRUDA ® als Teil einer Kombinationstherapie:
Dosierung von KEYTRUDA ® als Monotherapie:
Anwendung als
intravenöse Infusion
DOSIERUNG FÜR ALLE ZUGELASSENEN INDIKATIONEN 1
Dosierung 200 mg
oder
Dosierung 400 mg
Herstellung mit
2 x 100 mg KEYTRUDA ®
Konzentrat
oder
4 x 100 mg KEYTRUDA ®
Konzentrat









References by page
Überlegene Wirksamkeit unter KEYTRUDA ® Monotherapie vs. EXTREME
bei Patienten mit einer PD-L1-Expression (CPS ≥ 1). a,b
26%ige Reduktion des Sterberisikos unter KEYTRUDA® Monotherapie vs.
EXTREME (HR = 0,74; 95 % KI, 0,61 – 0,90; P=0.00133). 3
ÜberlegenE Wirksamkeit unter KEYTRUDA ®+Plat/5-FU vs. EXTREME
bei Patienten mit einer PD-L1-Expression (CPS ≥ 1). c
35%ige Reduktion des Sterberisikos unter KEYTRUDA®+ Plat/5-FU
vs. EXTREME (HR = 0,65; 95 % KI, 0,53 – 0,83; p=0.00002). 2
Die Mehrheit unerwünschter Ereignisse war Grad 1 oder 2. 1,2
KEYTRUDA ® kann als Erstlinienbehandlung als Monotherapie oder in Kombination eingesetzt werden. 1
Fixe Dosierung alle 3 Wochen (200 mg) oder alle 6 Wochen (400 mg).
für KEYTRUDA ® Monotherapie. 1,2
Fixe Dosierung alle 3 Wochen (200 mg) für KEYTRUDA ®+PLAT/5-FU. 1,2
a Patienten mit R/M HNSCC erhielten keine vorherige systemische Therapie im rezidivierenden / metastasierenden Setting.
b Patienten, die das EXTREME-Regime erhielten, erhielten Cetuximab + Carboplatin oder Cisplatin + Fluorouracil. 2
c Patienten, die KEYTRUDA ® + Chemotherapie erhielten, erhielten KEYTRUDA ® + Carboplatin oder Cisplatin + Fluorouracil.


